在动物复杂而有序的发育过程中,激素信号构成了一个高度协调的通讯系统,精准指挥生长、变态、代谢与繁殖等关键生命事件。作为发育生物学和遗传学的经典模型黑腹果蝇(Drosophila melanogaster)等完全变态昆虫由幼虫经蛹期至成虫,该完全变态过程为研究激素互作决定细胞命运的内分泌机制提供了绝佳窗口。
昆虫变态发育的核心调控者—保幼激素(Juvenile Hormone, JH)和20-羟基蜕皮激素(20-hydroxyecdysone, 20E)—之间的“对话”方式,吸引科学家们近百年的长期探究。近8年来,我校生命科学学院李胜教授领衔的团队以果蝇作为模型研究昆虫变态发育,在《美国国家科学院院刊》(PNAS, 共6篇)、《自然·通讯》(Nature Communications ,共2篇)等国际顶尖期刊上发表了系统性的研究成果。团队不仅深刻揭示了JH与20E在发育转换中的多重、动态互作机制,还创新性地将表观遗传调控引入这一经典激素信号网络,阐明了染色质可及性如何作为“分子开关”决定发育输出,更从单细胞分辨率、环境信号整合、组织重构、代谢协调、滞育调控以及细胞命运决定等多个维度,绘制出一幅从激素合成、信号传导到基因表达与细胞行为调控的调控图谱(图1),为理解生命过程的时序控制、可塑性及稳态维持提供了范式。
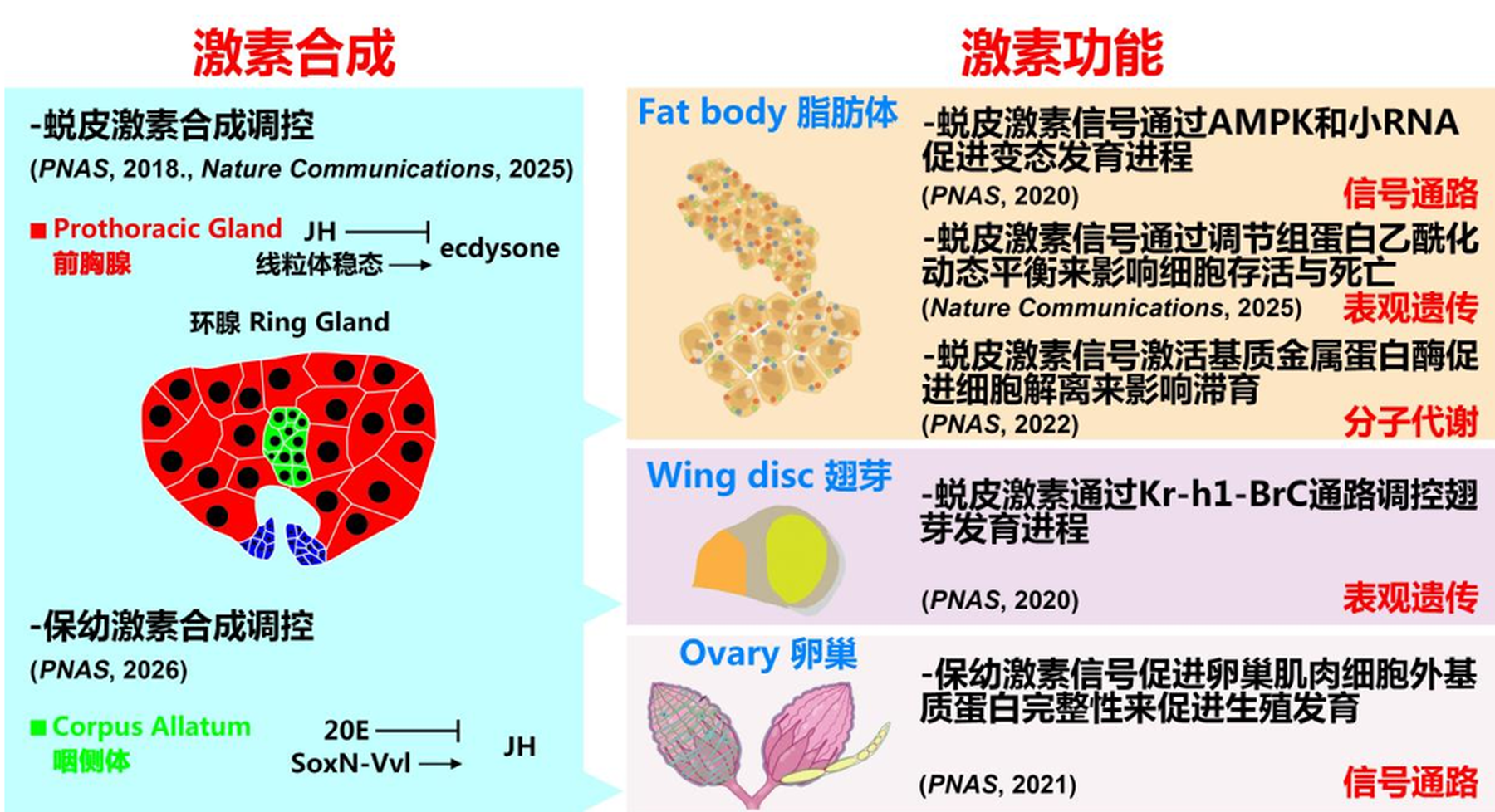
图1 激素合成与功能调控图谱
一、单细胞图谱与转录枢纽:SoxN-Vvl复合体支配JH生物合成
咽侧体(corpus allatum, CA)是JH的主要合成器官,对咽侧体的具体转录调控网络,长期缺乏高分辨率的解析。传统批量转录组学因CA细胞数量稀少且与环腺其他组织紧密粘连而受限。2026年2月2日,团队在PNAS发表题为“Single-cell transcriptomics of the Drosophila ring gland identifies SoxN-Vvl complex as key regulator of juvenile hormone biosynthesis”的研究论文,罗雨涵、陈楠、高月、罗威为共同第一作者,刘素宁、李胜为共同通讯作者。
团队通过单细胞RNA测序(scRNA-seq)技术,突破了这一瓶颈,构建了果蝇幼虫环腺的高分辨率细胞图谱(图2)。对7919个环腺细胞进行单细胞RNA测序,清晰解析了CA、前胸腺(PG)和心侧体(CC)三者截然不同的转录组特征,并准确区分了周边混杂的细胞类型。在CA细胞中鉴定出102个特异性高表达的基因,确定SoxN是关键转录因子,对JH的生物合成至关重要。机制探索揭示SoxN与另一个广泛表达的转录因子Vvl通过物理互作形成蛋白质复合体,转录激活JH关键合成限速酶基因Jhamt并诱导JH合成。该研究鉴定出了一个支配JH生物合成的核心转录调控模块。
核心意义:这项研究不仅提供了环腺首个单细胞转录图谱资源,更重要的是揭示了CA激素生产的核心转录机制。SoxN-Vvl复合体的功能,类似于多能性网络中的Sox2-Oct4搭档。确立了SoxN-Vvl在JH合成上游调控中的枢纽地位,为从源头理解JH滴度的调控提供了分子开关。
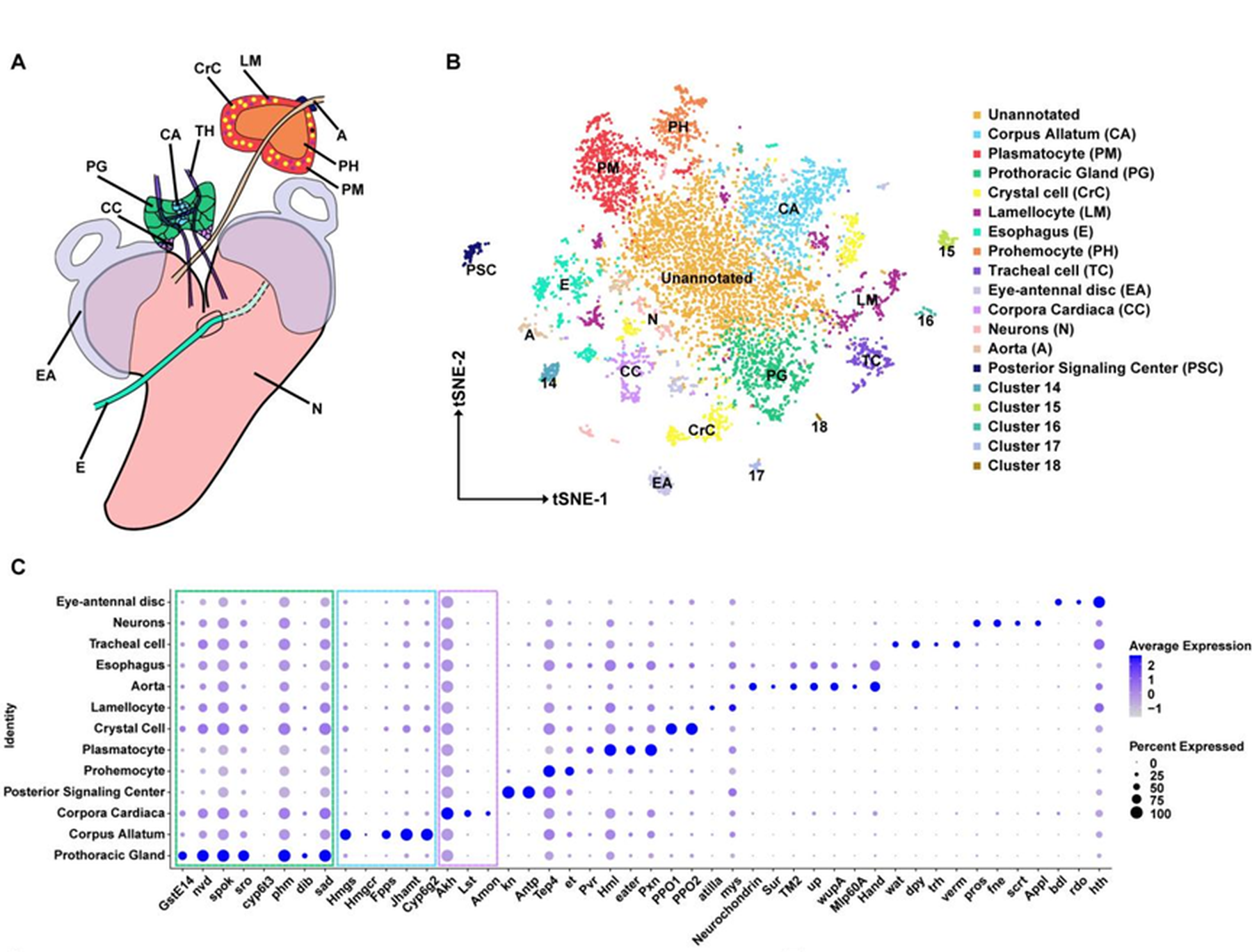
图2 果蝇环腺的单细胞测序
原文链接:https://www.pnas.org/dio/10.1073/pnas.2520504123
二、组蛋白乙酰化动态平衡:H3K14/27/8ac导航细胞存活与凋亡的命运抉择
在发育和组织重塑中,细胞存活与凋亡的平衡至关重要。2025年12月12日,团队在Nature Communications发表题为“Histone acetylation homeodynamics navigates cell survival and apoptosis”的研究论文,李康、田玲、曹文欣为共同第一作者,李胜为通讯作者。
团队将表观遗传调控的视角从发育时序扩展到了细胞命运决策,系统揭示了组蛋白乙酰化动态平衡如何精密导航细胞存活与凋亡。研究发现,在果蝇的脂肪体、唾液腺和翅盘等多种组织中,一组组蛋白乙酰转移酶(P300/Tip60)和去乙酰化酶/辅阻遏物(HDAC3/CtBP)构成调控系统,通过动态调节H3K14、H3K27和H4K8位点的乙酰化水平,直接控制凋亡相关基因的表达(图3)。与此同时,还发现一种精妙的反向调控机制:同一套表观遗传系统对凋亡基因(E93和RHG)和凋亡抑制蛋白(IAPs,如Diap1)基因的表达实施反向调控。这种对拮抗性基因对的“推拉式”乙酰化动态平衡,构成了决定细胞命运(存活 vs. 凋亡)的表观遗传枢纽。此外,该机制在哺乳动物A549肿瘤细胞中和小鼠模型中得到部分验证,提示其演化上的保守性。
核心意义:这项研究首次系统阐明了组蛋白乙酰化动态平衡如何作为上游表观遗传“总开关”,通过同步且反向地调控促凋亡与抗凋亡基因的染色质可及性,来导航细胞命运。它将激素信号(20E诱导E93)、转录因子与表观遗传修饰无缝衔接,并直接关联到肿瘤发生中“凋亡逃逸”的表观遗传基础,为理解发育编程性细胞死亡和疾病中细胞稳态失调提供了全新的机制框架和潜在治疗靶点。
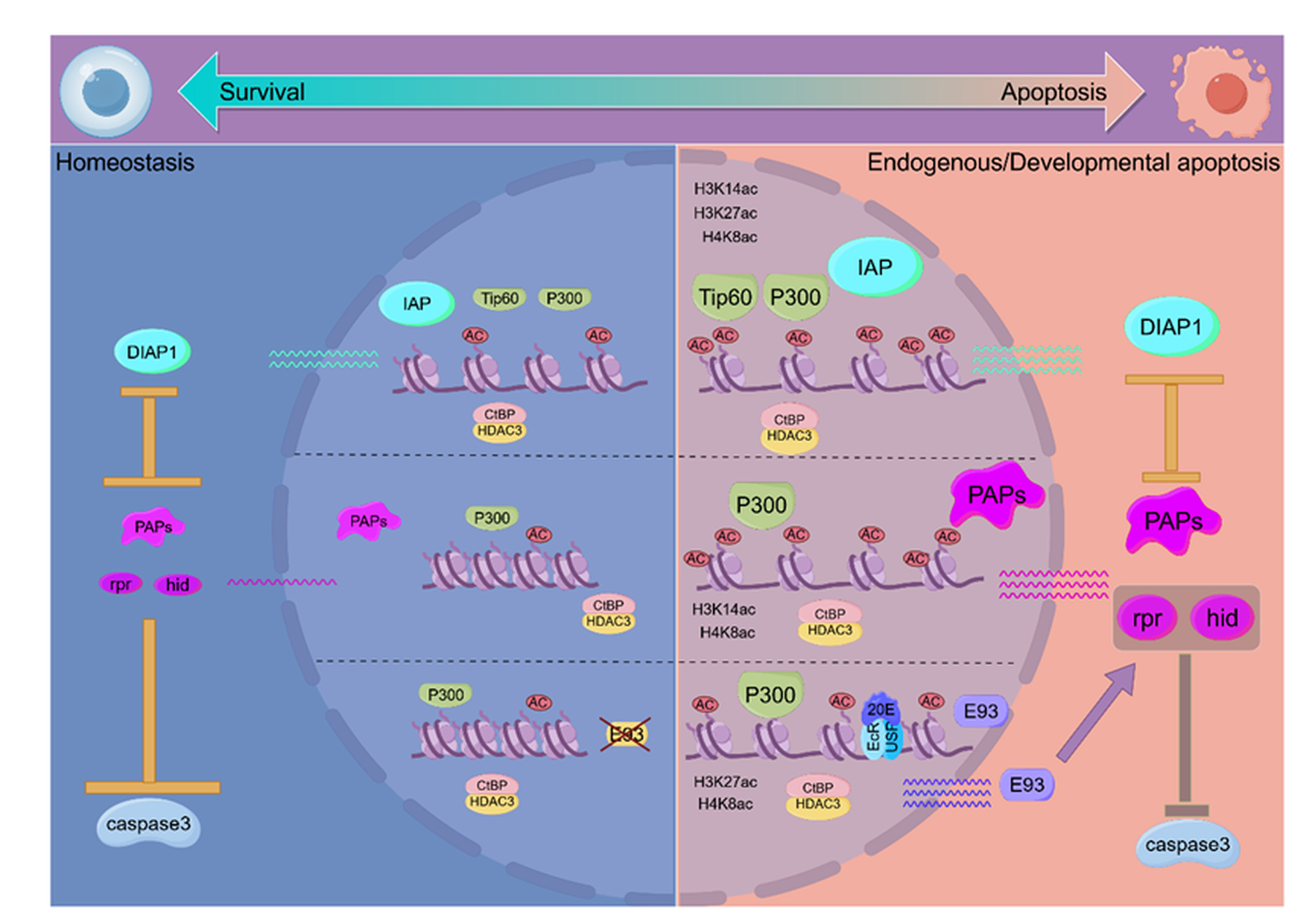
图3 Tip60/P300-CtBP/HDAC3在IAPs启动子处调节H3K14ac/H3K27ac/H4K8ac动态
原文链接:https://www.nature.com/articles/s41467-025-66405-4
三、表观遗传“开关”:染色质可及性决定Kr-h1对Br-C的双向调控
转录因子Kr-h1作为JH信号的核心执行者,其经典功能是抑制20E信号通路基因表达,从而维持幼虫状态。然而,在化蛹前期,当JH滴度降至极低时,蛹因子Br-C却需要高表达才足以驱动变态发生。这个矛盾引出了一个更深层的问题:Kr-h1是否以及如何在JH缺席的情况下发挥作用?2025年8月7日,团队在PNAS发表题为“20E-induced Kr-h1 expression facilitates developmental transitions depending on chromosome accessibility of BR-C enhancers”的研究论文,解开了这个谜团。龙诗慧、邱泳裕、林彤、黄淑敏、张文豪为共同第一作者,李康、李胜为共同通讯作者。
团队发现,在即将蛹化的翅盘中,20E可以直接诱导Kr-h1的表达。这种诱导不依赖于JH,而是通过20E受体EcR/USP直接结合在Kr-h1 基因启动子中的一个保守的蜕皮激素反应元件(EcRE)上来实现。Kr-h1此时扮演了完全相反的角色—激活Br-C表达。在幼虫到预蛹转变过程中,高浓度20E信号招募组蛋白乙酰转移酶P300,在Br-C两个包含PKBS的增强子区域催生高水平的H3K27ac修饰,增加了染色质的开放性和可及性,从而诱导Br-C表达。与20E EcR/USP协同,强力驱动Br-C的最大化表达,最终导致化蛹(图4)。
核心意义: 这项研究是开创性,甚至是颠覆性的。它首次在动物发育模型中展示,同一转录因子(Kr-h1)如何响应不同的激素信号(JH vs. 20E),并依赖于染色质状态(关闭的启动子 vs. 开放的增强子),对同一关键靶基因(Br-C)实施完全相反的转录调控(抑制 vs. 激活)。这完美解释了发育阶段转换的“不可逆性”和“精准性”,将激素信号、转录因子与表观遗传机制紧密耦合,为理解发育的时序逻辑提供了全新的分子范式。
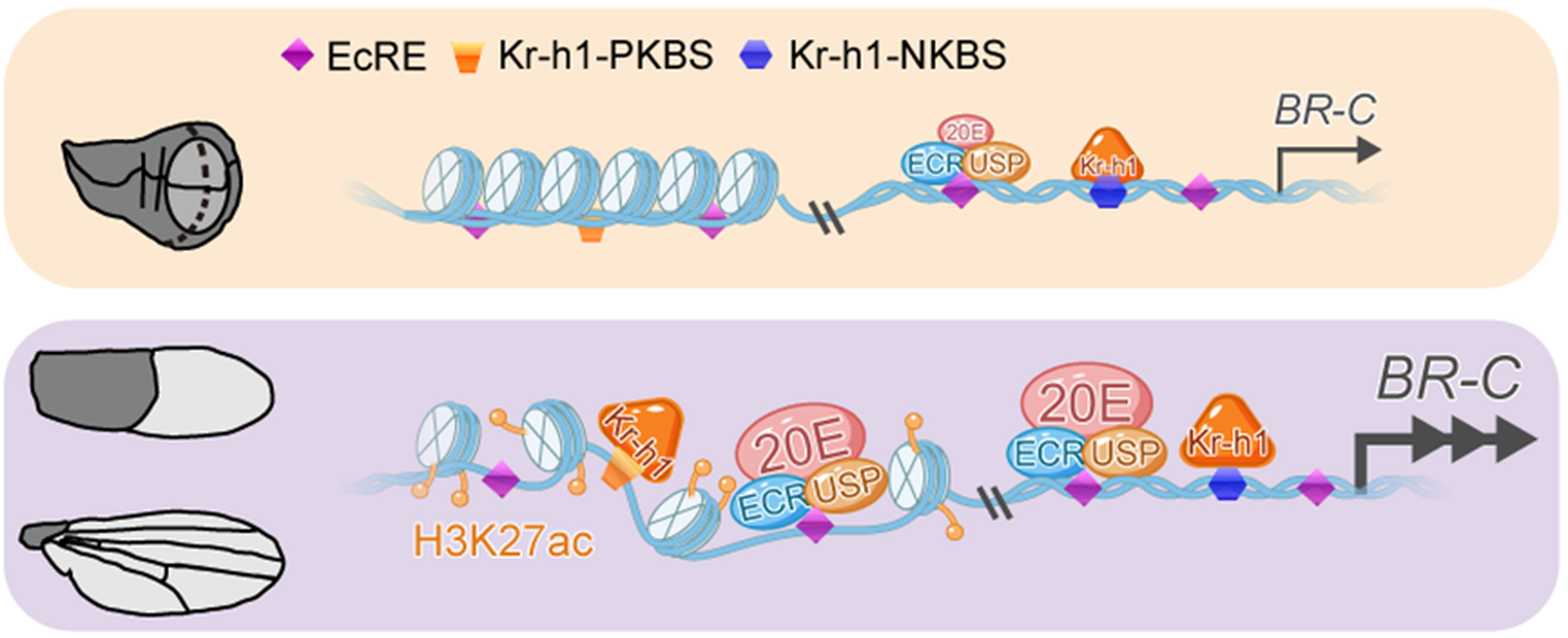
图4 20E通过EcR/USP和Kr-h1促进Br-C表达的分子机制
原文链接:https://www.pnas.org/dio/abs/10.1073/pnas.2509608122
四、环境感应与细胞器动力学:营养状态通过线粒体稳态开关类固醇合成
变态发育进程必须灵活应对环境波动,尤其是营养可得性。2025年2月1日,团队在在Nature Communications发表题为“Nutrient status alters developmental fates via a switch in mitochondrial homeodynamics”的研究论文,张捷、刘素宁、李阳为共同第一作者,刘素宁、Kirst King-Jones、李胜为共同通讯作者。
团队深入揭示了在“营养限制检查点”前后,饥饿信号如何通过截然不同的方式重塑前胸腺的线粒体动态,从而决定类固醇激素合成的命运。研究发现,在检查点之前遭遇饥饿,会显著下调前胸腺中大量线粒体相关基因的表达,导致线粒体从促进合成代谢的碎片化状态转变为融合的管状网络。这种形态转变虽能提升ATP生产以应急,却意外阻断了类固醇合成关键酶Dib向线粒体的输入,并诱发严重的线粒体自噬和蛋白酶体功能障碍,最终完全关闭蜕皮激素合成,导致变态发育失败。与之形成鲜明对比的是,在检查点之后遭遇饥饿,则不会破坏线粒体稳态。此时,营养压力通过下调脂质代谢基因sit的表达并激活适度的自噬,协同促进储存胆固醇的动员,反而加速了蜕皮激素的合成,导致早熟变态(图5)。
核心意义: 该研究将外部营养信号与内部细胞器功能直接耦合,阐明了环境压力通过“重编程”线粒体这一细胞能量与代谢中心的状态,来精密控制发育激素产出与发育时序的可塑性机制,为理解生物如何根据资源状况调整发育策略提供了细胞生物学基础。
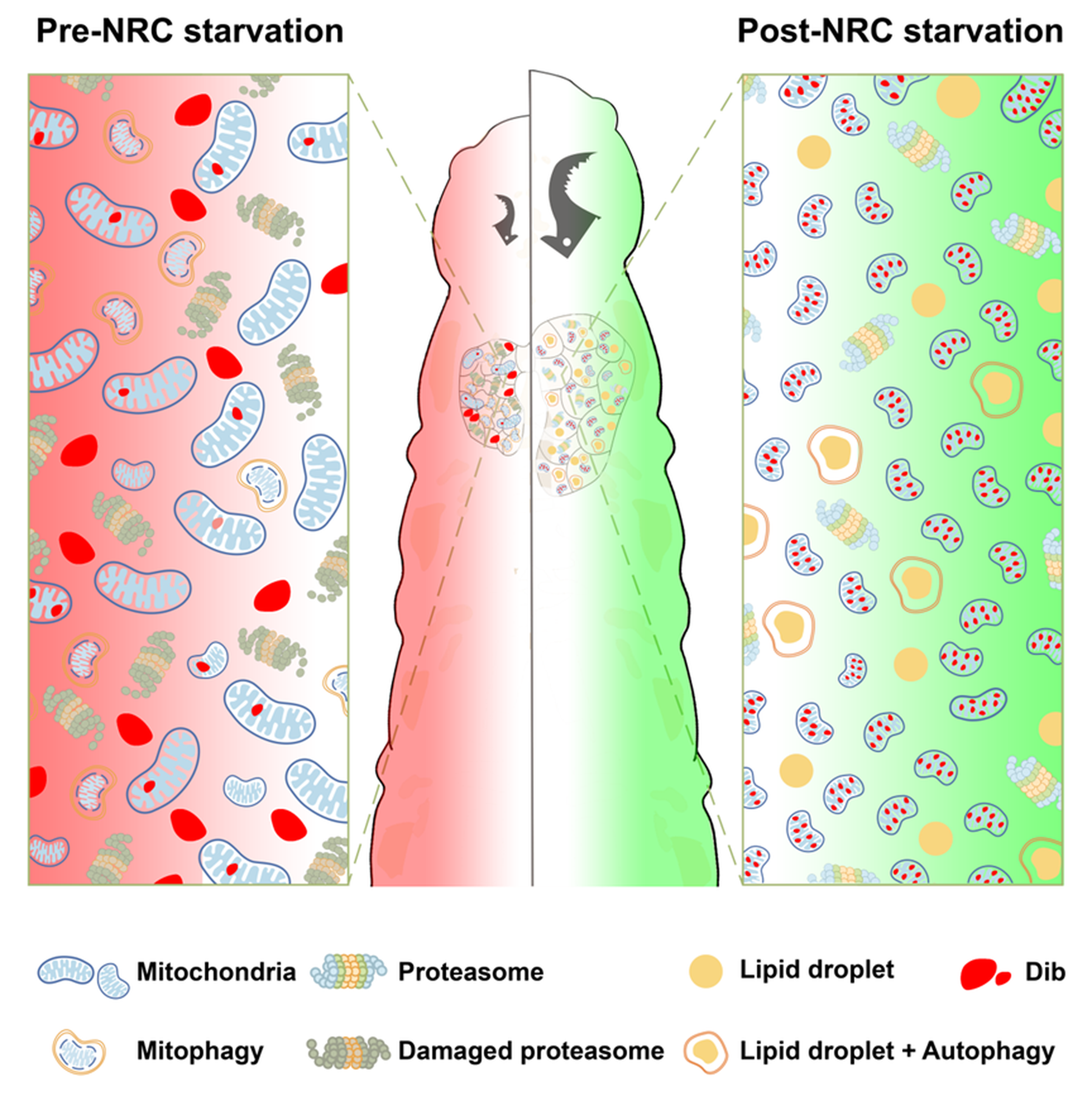
图5 营养限制检查点前后饥饿信号重塑前胸腺的线粒体动态决定类固醇激素合成
原文链接:https://www.nature.com/articles/s41467-025-56528-z
五、脂肪体细胞解离:Mmp介导的组织重构是蛹发育推进与滞育规避的代谢开关
脂肪体是昆虫的能量储存和代谢中心,其形态在变态过程中发生剧烈变化。2022年12月27日,团队在PNAS发表题为“Mmp-induced fat body cell dissociation promotes pupal development and moderately averts pupal diapause by activating lipid metabolism”的研究论文,贾强强为第一作者,李胜为通讯作者。
团队以棉铃虫为模型,揭示了脂肪体细胞解离这一组织重构事件,不仅是发育的结果,更是驱动蛹发育和影响滞育决策的主动调节过程。在非滞育蛹中,组织蛋白酶L(CatL)被激活,进而激活基质金属蛋白酶(Mmps)。Mmps降解包裹脂肪体细胞的细胞外基质(ECM)蛋白(如E-钙粘蛋白、IV型胶原蛋白),导致脂肪体从片层组织解离为单个细胞。这一解离过程并非被动伴随发育,而是通过转录重编程激活了脂肪体内的脂质代谢。释放到血淋巴中的脂质(如二酰甘油)提供了能量底物,并可能作为信号分子,提升脑部的线粒体呼吸活性和胰岛素信号,从而促进整体蛹发育进程。在滞育蛹中,CatL和Mmp的活性始终维持在低水平,脂肪体保持结构完整,脂质动员被抑制,代谢处于抑制状态,从而维持滞育。功能实验证明,抑制Mmp活性会延迟蛹发育并适度提高在近临界光周期条件下的滞育发生率;反之,促进脂肪体细胞解离则能适度避免滞育发生(图6)。
核心意义:该研究确立了脂肪体细胞解离作为连接组织形态、代谢激活与发育进程的关键节点。它表明,一种组织水平的结构变化(细胞解离)可以通过引发系统性的代谢重编程,主动影响发育速度和滞育这种发育停滞状态的维持与否,揭示了外周组织在整合发育信号和调控全身性发育程序中扮演的主动角色。
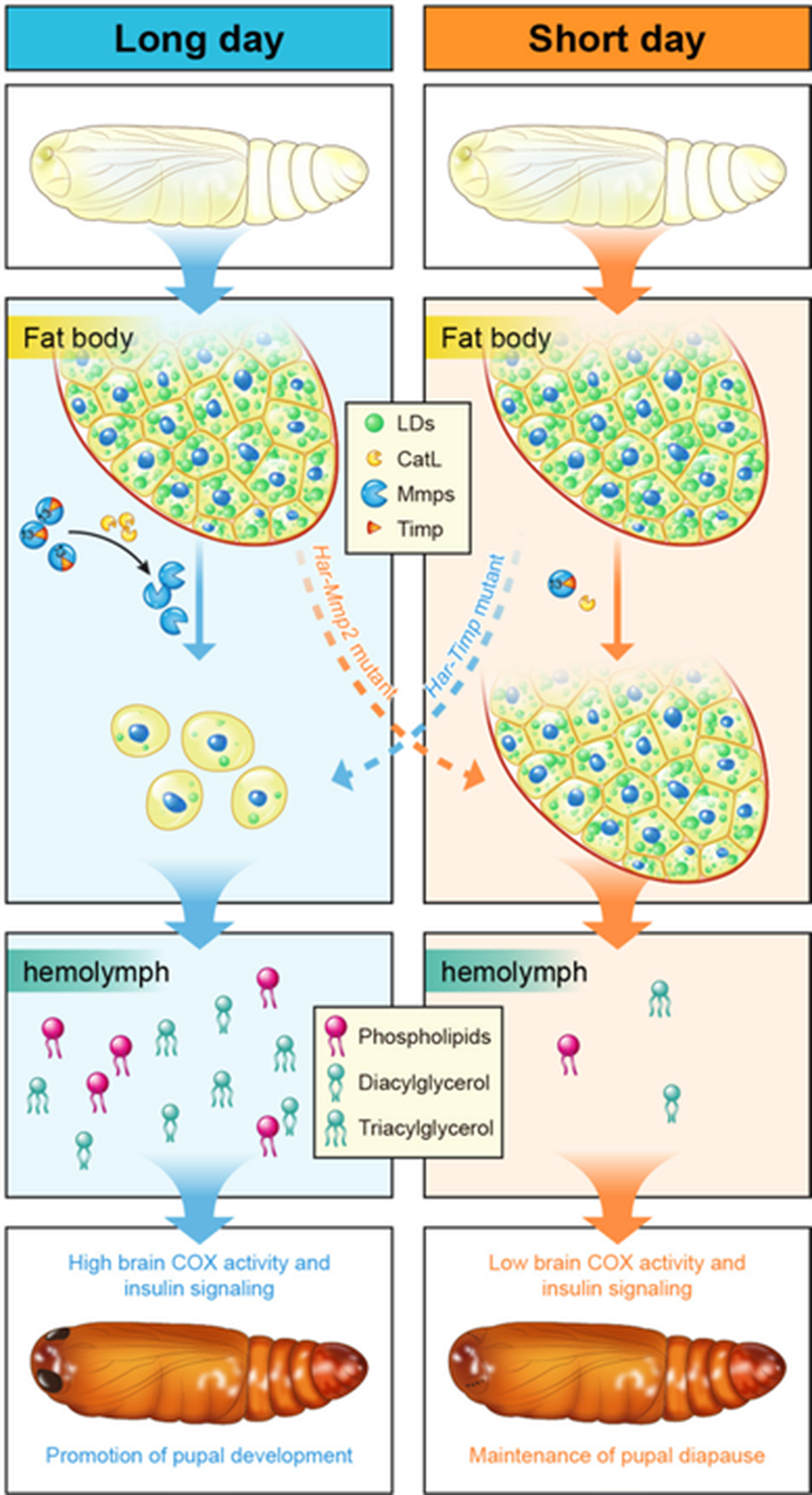
图6 脂肪体细胞解离在蛹期发育和滞育中的功能
原文链接:https://www.pnas.org/doi/10.1073/pnas.2215214120
六、超越促卵黄发生:JH调控生殖力学与细胞外基质重构
JH在成虫期作为“促性腺激素”促进卵子发生的功能广为人知,但其作用机制多集中于诱导卵黄蛋白生成与摄取。2021年9月20日,团队在PNAS发表题为“Juvenile hormone signaling promotes ovulation and maintains egg shape by inducing expression of extracellular matrix genes”的研究论文,罗威、刘素宁共同第一作者,刘素宁、李胜为共同通讯组织。
团队揭开了JH调控雌性生殖的全新维度,即通过调控细胞外基质(ECM)的合成来影响组织力学与形态发生。发现JH信号在卵巢中特异性地在包裹卵室的肌肉细胞中被激活。JH通过其细胞内受体Met/Gce诱导这些肌肉细胞表达层粘连蛋白等ECM成分。与此同时,JH信号也在成体脂肪体中激活,诱导合成IV型胶原蛋白。这些脂肪体合成的胶原蛋白被分泌到血淋巴中,远程运输并沉积到卵巢肌肉表面。局部合成的层粘连蛋白与远程供应的胶原蛋白共同组装成卵巢肌肉细胞周围坚韧而富有弹性的ECM。一个结构完整的ECM对于肌肉细胞中肌节的有序排列和高效收缩至关重要。实验证明,无论是抑制JH信号还是直接敲低这些ECM基因,都会导致卵巢肌肉收缩无力、节律紊乱,从而无法将成熟卵子挤出卵巢(排卵障碍),同时也会减弱卵室在发育过程中受到的、来自肌肉的定向机械约束,导致卵子不能正常伸长(图7)。
核心意义:这项研究将JH的生殖调控功能从生物化学领域(卵黄发生)拓展到了生物力学和组织工程领域。它揭示了激素如何通过协调不同器官(脂肪体与卵巢)的基因表达,共同构建一个支持生殖功能的机械微环境。这为理解激素在多器官通讯、组织形态发生中的作用提供了崭新视角。
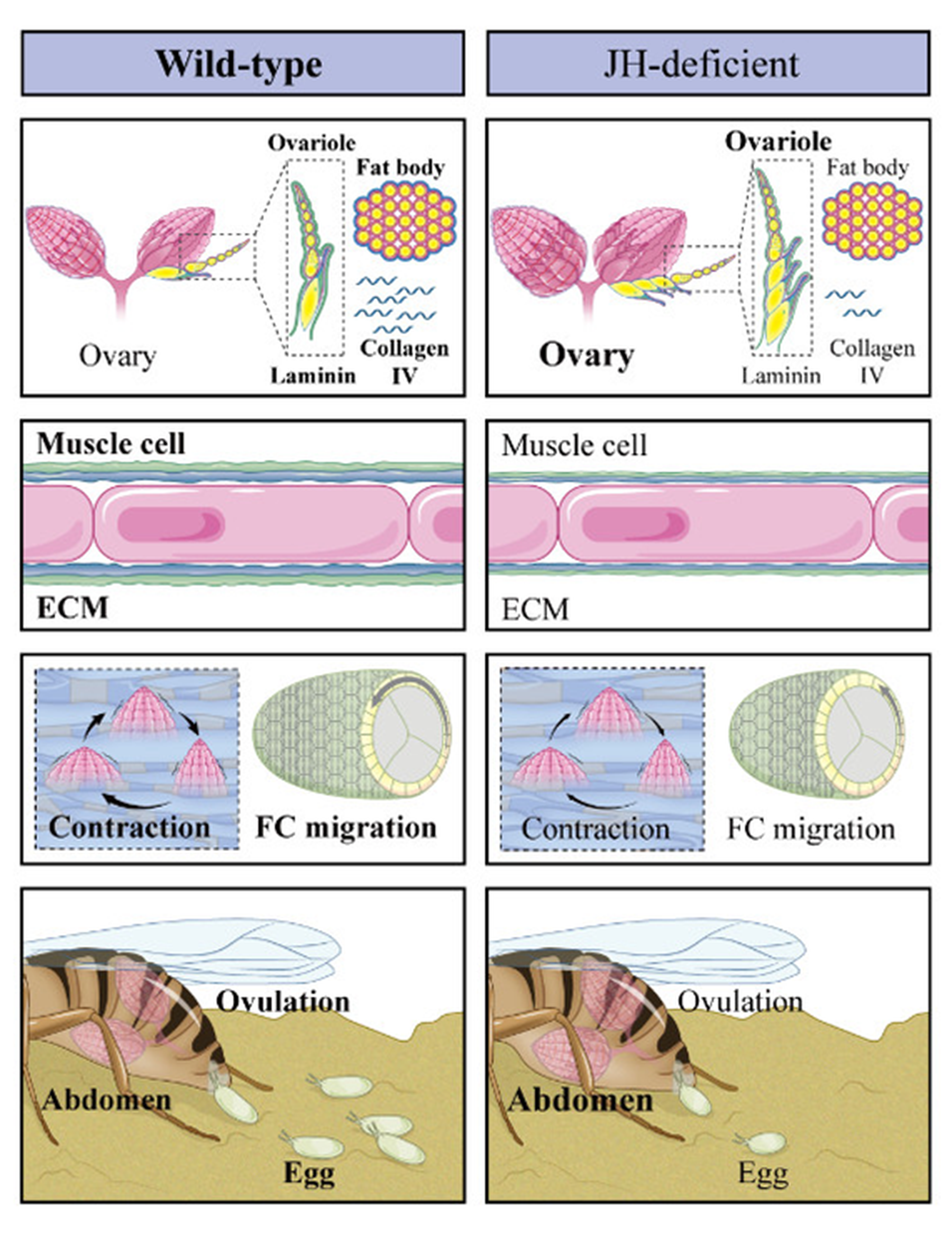
图7 JH信号诱导ECM基因表达以促进排卵和维持卵形状
原文链接:https://www.pnas.org/dio/10.1073/pnas.2104461118
七、代谢与生长的交汇点:20E通过AMPK-PP2A轴整合能量感应与生长信号
发育不仅是形态的转变,也伴随着生长速率的精密调控。2020年4月28日,团队在PNAS发表题为“The AMPK-PP2A axis in insect fat body is activated by 20-hydroxyecdysone to antagonize insulin/IGF signaling and restrict growth rate”的研究论文,袁冬伟、周顺、刘素宁为共同第一作者,李胜为通讯作者。
团队将20E的信号功能从“发育计时器”扩展到了“生长调节器”,并阐明了其与核心代谢-生长通路—胰岛素/胰岛素样生长因子信号(IIS)—的交汇机制。发现在化蛹前期,高浓度的20E在脂肪体中激活了一个关键的细胞能量感应器:AMP活化蛋白激酶(AMPK)。20E通过两种方式激活AMPK:一是直接转录上调AMPK各亚基的表达;二是通过诱导幼虫 wandering行为(寻找化蛹场所)和减少摄食,引发一种“饥饿样”状态,提高细胞内AMP/ATP比率,从而激活AMPK。被激活的AMPK并未止步于能量代谢调节。研究进一步揭示,AMPK会上调蛋白磷酸酶2A(PP2A)的活性。PP2A作为一个去磷酸化酶,直接作用于IIS通路的核心组分,包括胰岛素受体(InR)和蛋白激酶B(AKT),使其去磷酸化而失活。这一系列事件最终导致IIS信号及其下游的促合成代谢通路被抑制(图8)。
核心意义:该研究突破了20E仅作为“发育计时器”的传统认知,揭示了其通过代谢感应通路拮抗生长信号、协调发育时序与资源分配的深层机制。这为理解动物如何根据发育阶段调整生长速率提供了经典范例,也暗示了代谢疾病与发育失调之间可能存在保守的调控纽带。
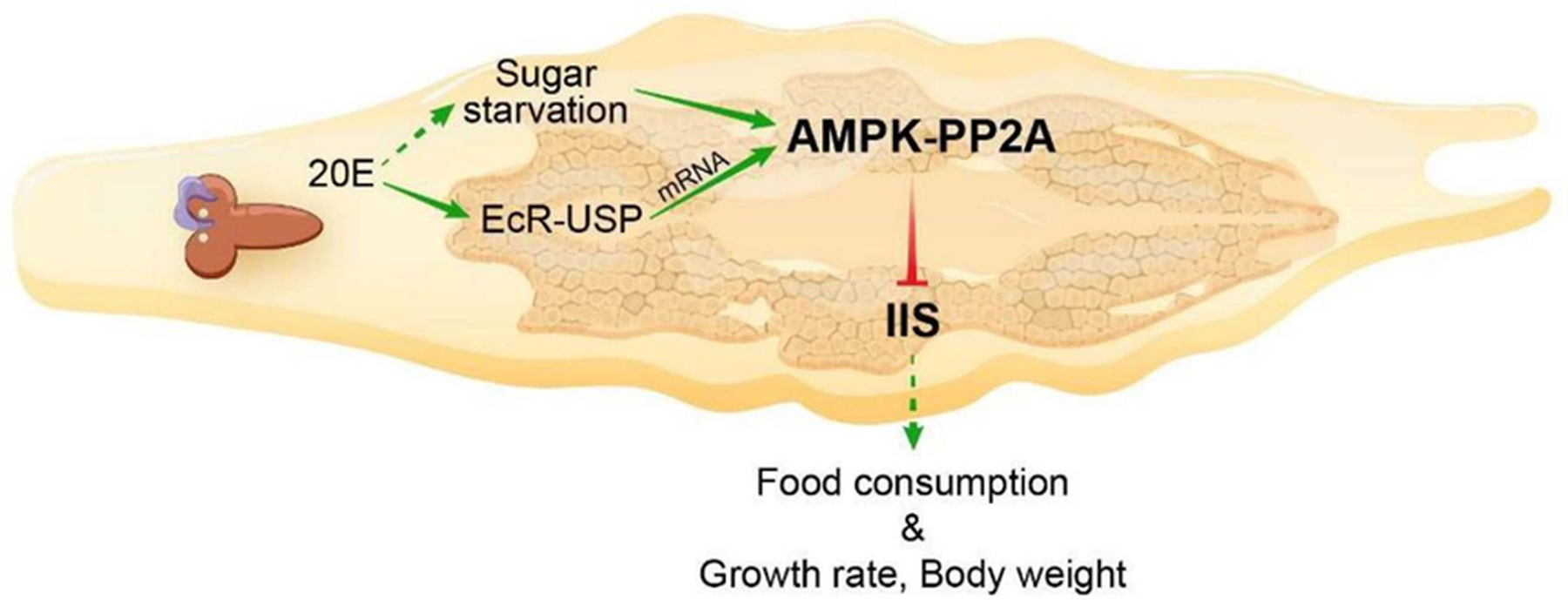
图8 AMPK-PP2A在20E和IIS信号通路中的桥梁作用
原文链接:https://www.pnas.org/doi/full/10.1073/pnas.2000963117
八、环腺:激素拮抗的“主战场”,发育转换的“决策中心”
2018年1月2日,团队在PNAS发表题为“Antagonistic actions of juvenile hormone and 20-hydroxyecdysone within the ring gland determine developmental transitions in Drosophila”的研究论文,为理解JH与20E的经典拮抗关系提供了突破性的空间定位和分子机制。传统理论认为,这两种激素在体液环境中通过浓度消长来协调发育,但其直接相互调控的源头与节点并不清晰。
团队将目光聚焦于果蝇幼虫的内分泌中枢—环腺。这个微型器官由前胸腺、咽侧体和心侧体三部分融合而成,恰是合成20E前体(蜕皮酮ecdysone)和JH的“工厂”。研究发现,JH信号在前胸腺细胞中通过其受体Met/Gce诱导关键转录因子Kr-h1的高表达。高水平的Kr-h1进而通过双重方式抑制蜕皮酮的生物合成:一是抑制类固醇合成自调控回路中EcR、Br-C等正反馈因子的表达,二是独立于20E信号地减少前胸腺的细胞大小与内循环。这就如同在20E的“生产车间”内设置了一个由JH控制的“刹车”系统。反之,20E信号则在环腺的另一端—咽侧体—发挥对称的抑制作用。这种在同一腺体不同区域、相互抑制对方生物合成的模型,揭示了发育转换的内在核心是一个精密的“双激素双向负反馈开关”(图9)。
核心意义:这项研究首次在空间和分子层面描绘了JH与20E相互拮抗的“主战场”,将经典的激素浓度滴定模型升级为在关键内分泌器官内发生的、主动的相互基因表达调控模型。它回答了昆虫发育生物学中一个长期悬而未决的根本问题,并为理解其他动物(包括哺乳动物)中类固醇激素与相关激素的互作提供了新颖的框架。
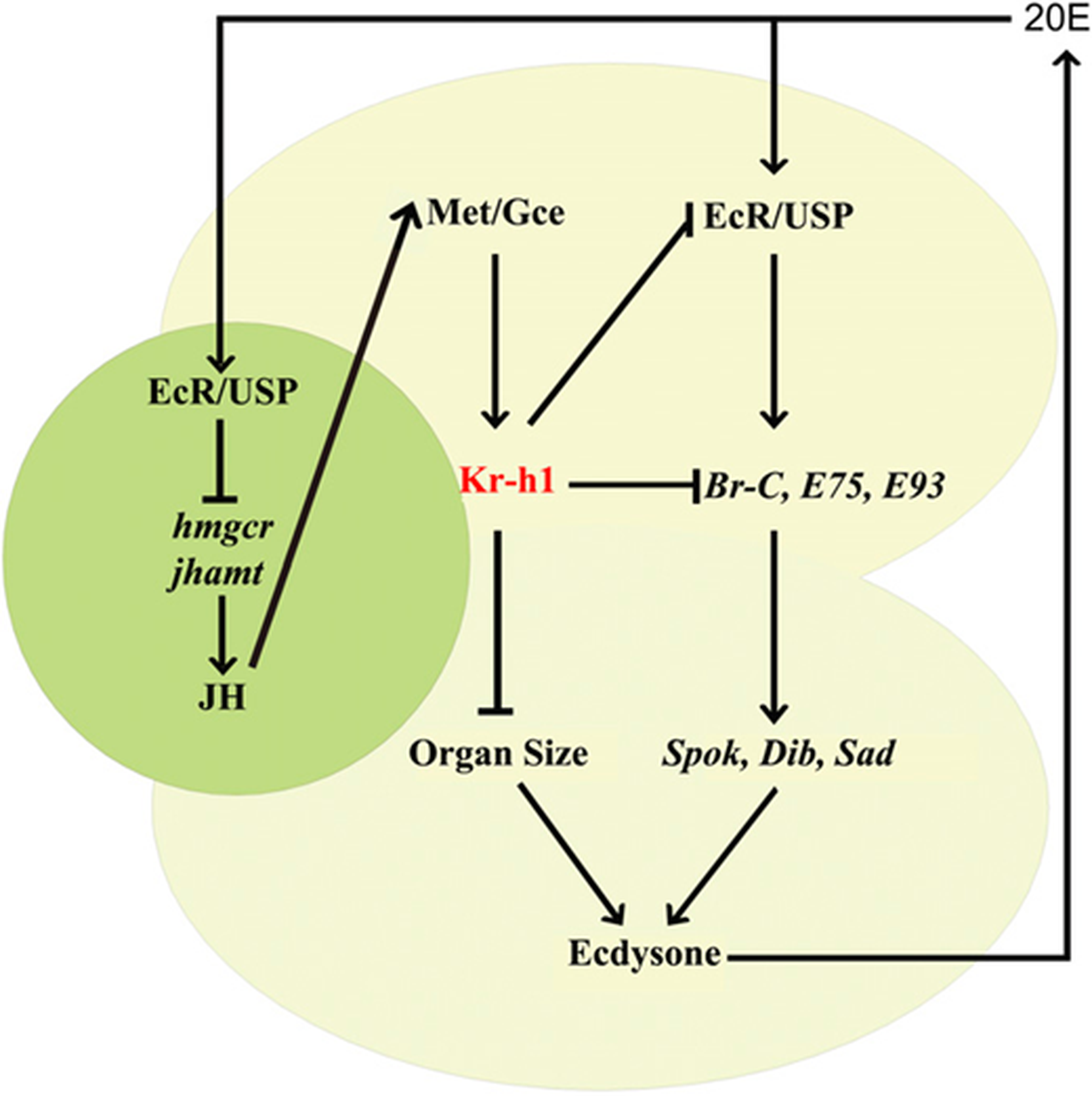
图9 JH和20E在环腺中生物合成和作用的调控网络
原文链接:https://www.pnas.org/doi/full/10.1073/pnas.1716897115
总结与展望
综上所述,李胜团队通过系统完整地将果蝇及昆虫的变态发育与激素功能调控研究推向了一个新的高度。他们从空间上锁定了激素互作的核心战场(环腺),从转录源头鉴定了JH合成的支配因子(SoxN-Vvl),从环境整合层面揭示了营养信号通过细胞器动力学控制激素合成的开关机制,从系统层面阐释了20E通过代谢通路协调生长与发育的策略,从组织重构角度揭示了脂肪体解离作为发育推进的主动调节事件,从表观遗传层面阐明了组蛋白乙酰化动态平衡决定细胞存活/凋亡命运的根本性开关,从组织力学角度拓展了JH的生殖调控维度,并最终在分子层面揭示了染色质可及性如何作为决定发育转换方向的终极“调谐器”。
这些工作共同绘制出一幅多维、动态、精密的生命调控全景图:环境信号(营养)与内部计时信号(激素)汇聚于关键内分泌器官与组织,通过调控细胞器功能、转录复合物形成、组织形态重构和染色质景观,最终精确指挥基因表达的时空程序与细胞行为,决定生长、变态、滞育、凋亡与繁殖的命运。这一框架不仅深刻阐述了昆虫发育与稳态的奥秘,其中涉及的激素互作、代谢-生长耦合、环境-发育整合、表观遗传开关、组织力学以及细胞命运决策等核心原理,对于理解哺乳动物青春期启动、组织再生、代谢疾病、肿瘤发生乃至衰老等广泛的生命过程,都具有重要的启示意义。未来,结合更多的单细胞多组学、实时成像、定量系统生物学以及跨物种比较研究,将进一步揭示这一复杂调控网络的动态细节、演化轨迹及其在生命健康中的应用潜能。




